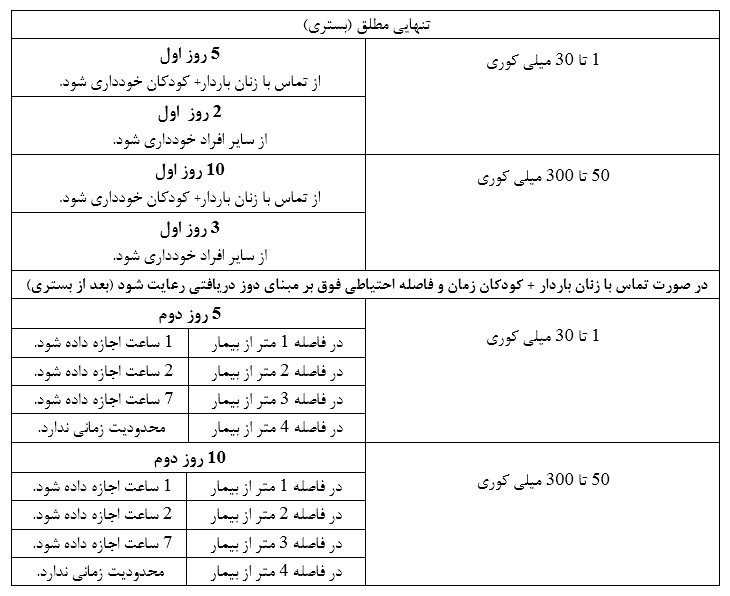
درمان با لوتیشیوم-۱۷۷ PSMA
در حال حاضر سرطان پروستات شایع ترین بدخیمی شناخته شده و دومین علت شایع مرگ و میر در آقایان می باشد. کانسر پروستات در درصد قابل توجهی از بیماران به درمانهایی نظیر جراحی و یا پرتودرمانی پاسخ می دهد. این بیماری می تواند ماهیت تهاجمی پیدا کند و قابل کنترل با درمانهای معمول (پرتودرمانی، شیمی درمانی و هورمون تراپی) نمی باشد لذا از درمانهای جایگزین همانند درمان با لوتشیوم استفاده می شود. لوتشیوم داروی ساتع کننده امواج گاما و بتا می باشد. تجمع بیش از حد پروتئن PSMA در سلول های سرطانی باعث فعال شدن همسان سازی یا به عبارت دیگر بزرگتر شدن تومورها شده که در نتیجه منجر به رشد و تکثیر بی رویه آنها و سرایت آن به دیگر نقاط می گردد. تمام انرژی از طریق تابش بتا بین ۱ تا ۲ میلی متر در داخل بافت نفوذ داردو سلولهای ناشی از سرطان پروستات تجمع پیدا کرده و باعث نابودی سلولهای سرطانی می شود. لوتیشیوم -۱۷۷ یک اتم است که ذرات رادیو اکتیو را ساطع می کند اتم لوتیشیوم که رادیو اکتیو به آن متصل است از طریق یک حامل به نام آنتی ژن اختصاصی غشاء پروستات به تومور پروستات وصل می شود. در بدن، لوتیشیوم -۱۷۷ به سلول های خاص تومور متصل می شود و این سلول های سرطانی را از بین می برد. لوتیشیوم -۱۷۷ PSMA که توسط سلول های تومور جذب نمی شود، بوسیله عرق، بزاق، ادرار و مدفوع از بدن شما خارج می شود. این دارو در اکثر موارد موجب افزایش طول عمر بیماران، افزایش کیفیت زندگی و پسرفت بیماری شده است. درحال حاضر این شیوه نوین درمانی در مراکز معدودی در کشور از جمله موسسه پزشکی هسته ای دکتر کاظمی انجام می گردد.
مدارکی که برای درمان مورد نیازخواهد بود:
شما قبل از درمان بار اول نیاز به یک اسکن جهت شناخت اولیه نیاز دارید که ممکن است درحال حاضرانجام داده باشید.
شما به یک آزمایش نیاز دارید که دکتر شما برایتان ترتیب خواهد داد، به شرح زیر:
۱- تست خون دو هفته قبل ازدرمان
۲- یک اسکن ۲۴ ساعت، ۴۸ ساعت، و ۷۲ ساعت پس از درمان انجام می شود.
۳- آزمایش خون در حدود ۲ هفته و ۶ هفته پس از درمان.
- آیا آماده سازی قبل از درمان وجود دارد؟
در صورت انجام شیمی درمانی و یا پرتودرمانی (در ناحیه لگن و یا ستون فقرات) در ۴ هفته اخیر حتما اطلاع داده شود. اطمینان حاصل شود که شیمی درمانی و رادیوتراپی برای حداقل ۴ هفته متوقف شده است. اگر شما احساس ناخوشی قبل از تاریخ درمان دارید لطفا به ما اطلاع دهید.
- درمان با لوتیشیوم-۱۷۷ چگونه انجام می شود؟
در بیماران به منظور جلوگیری از بروز آلودگی سونداژ انجام می شود در پایان سونداژ و کیسه ادرار خارج می شود و جهت اقدامات حفاظتی در بخش پسمانداری مرکز نگهداری می گردد. درطول ۱۲ساعت پس از درمان مقدارزیادی از مواد رادیواکتیویته از طریق ادرار از بدن شما خارج می شود و باید احتیاط شود.
پک خنک کننده غدد بزاقی نیم ساعت قبل از درمان به بیمار داده می شود و تا ۴ ساعت بعد از تزریق به منظور جلوگیری از کاهش عملکرد غدد بزاقی به دنبال درمان استفاده شود. نحوه استفاده از پک خنک کننده غدد بزاقی توسط پرستار آموزش داده می شود.
به شما داروی ضد تهوع (احساس ناراحتی در معده) در صورت مشکل داده می شود.
درمان از طریق تزریق یک قطره به ورید در حد چند دقیقه انجام می شود.
همچنین به شما یک حدود ۲ لیتر در ۲۴ ساعت از طریق رگ برای محافظت از کلیه های شما و دفع سریتر اشعه داده می شود.
- پیگیری های بعد از درمان
۲۴ و ۴۸ و ۷۲ ساعت بعد از درمان اسکن PSMA انجام می شود.
هر دو هفته یک بار آزمایش خون برای شمارش گلوبولهای قرمز و سفید، عملکرد کبد و کلیه و هر ۴ هفته یک بار آزمایش PSA انجام می شود.
- آیا هر گونه خطری برای خانواده و یا دوستان من وجود دارد؟
در این نوع درمان اشعه ساطع شده از رادیودارو در درون بدن باقی میماند و فقط مقادیر بسیار کمی از اشعه از بدن خارج می شود. پس از خروج از مرکز، خانواده و دوستانتان در معرض خطر نیستند اما برخی اقدامات احتیاطی را توصیه می کنیم:
– تا یک هفته پس ازدرمان، همیشه سیفون توالت را پس از استفاده دو بار بکشید.
– خودداری از هر گونه تماس با کودکان و زنان باردار به مدت ۳ روز
– محدود کردن تماس نزدیک با دیگر بزرگسالان به مدت ۳ روز
– اجتناب از به اشتراک گذاری تخت با شخص دیگری به مدت ۳ روز
- به چند درمان نیاز خواهم داشت؟
معمولا ۴ تا ۵ درمان هر ۸-۱۲ هفته بعد از هر درمان داده می شود. و بعد از هر درمان بیمار ارزیابی مجدد سلامت و پاسخ درمان باPSMA خود را مشاهده خواهد کرد. درمان های بعدی به اثرات درمانی که بر روی سلول های خونی و PSA، کلیه و کبد شما بستگی دارد. ارزیابی کلینیکی پس از هر درمان (از جمله خون و اسکن) ۲ هفته قبل از چرخه درمان بعدی باید انجام شود.
- آیا اثرات جانبی دارد؟
بیشترین گزارش، حالت تهوع است، اما قبل ازدرمان برای جلوگیری از تهوع ما به شما دارو می دهیم البته اگر لازم باشد و همچنین قرص هایی که بعد از آن در منزل مصرف کنید.
- دیگر اثرات جانبی به شرح زیر است:
– افت گلوبولهای قرمز و سفید به صورت گذرا
– ریزش مو بشکل گذرا
– احساس خشکی دهان به علت کاهش عملکرد غدد بزاقی
– کاهش در عملکرد کلیه بویژه در افراد با سابقه بیماری کلیه
– خستگی
– بروز تهوع و خستگی در یک هفته اول بیماری
مطلب مرتبط با اسکن تمام بدن: اسکن تمام بدن استخوان
در سلول های اعصاب و غدد درون ریز مانند: غدد آدرنال، پانکراس، تیروئید و هیپوفیز، تخمدان ها و بیضه ها و دردستگاه تنفسی و گوارشی تشکیل شده است. اکثرتومورها دردستگاه گوارش بوجود می آیند که به عنوان تومورهای اعصاب و غدد گوارشی معرفی می شوند. تومورهای اعصاب وغدد پانکراس به عنوان دومین تومورها شناخته می شوند و براساس شایع ترین هورمون هایی که درآنها تولید می شود، آنها را نامگذاری می کنند. قسمت های نادر برای اعصاب و غدد، تومورهای تیموس، غدد آدرنال،تیروئید، پوست، تخمدان، بیضه ها و غدد بزاقی هستند. قسمت هایی که درآن تومورهای اعصاب و غدد می توانند ظاهرشوند. توموراعصاب و غدد به دو طبقه تقسیم بندی شده اند: تومورهای عملکردی که هورمون تولید می کنند وغیر عملکردی که هورمون تولید نمی کنند. تومورهای عملکردی اغلب زود تشخیص داده می شوند، به این دلیل که با تولید بیش ازحد هورمون باعث می شود که افراد احساس ناخوشایندی داشته باشند. با این حال، علائمی که ازتولید هورمون بوجود می آیند می توانند کاملا غیراختصاصی باشند. رایج ترین تومورهای عملکردی تومورکارسینوئید است که هورمون سروتونین اضافه تولید می کنند، بنابراین بوسیله کبد نمی تواند شکسته شود. این هورمونی است که باعث تولید سندرم کارسینوئید می شود. دومین تومورهای رایج عملکردی، توموراعصاب وغدد پانکراس است. تومورهای عملکردی اعصاب وغدد دردسته فئوکروموسیتو و پاراگانگلیوما را می توان نام برد. دربسیاری ازموارد، تومورهای غیر عملکردی بصورت آهسته درحال رشد هستند و می توانند سالها غیرقابل تشخیص باشند. اغلب افرادی که درد شدید درناحیه شکم دارند، که ممکن است منجربه انسداد نسبی روده شود و می بایست حتما به پزشک مراجعه کنند. شایعترین تومورهای اعصاب وغدد عبارتند از:
Carcinoid, Gastrinoma, Glucagonoma, Insulinoma, PPoma, Somatostatinoma, Corticotrophinoma, Gonadotrophinoma, Somatotrophinoma, Thyrotrophinoma, Prolactinoma, Parathyroid adenoma, Pheochromocytoma, Ganglioneuroma, Ganglioneuroblastoma, Medulloblastoma, Neuroblastoma, Medullary thyroid carcinoma, Paraganglioma, Vasoactive Intestinal Polypeptide VIPoma, Non‐Functioning Islet Cell carcinoma.
درمان I-131 MIBG
یک درمان سیستماتیک است که در درمان بعضی تومورها ی اعصاب و غدد مانند فئوکروموسیتوم، پاراگانگلیوم، نوروبلاستوم، سرطان مدولاری تیروئید و تومورهای کارسینوئید و تومورهای اعصاب وغدد متاستاتیک غیرقابل جراحی مورد استفاده قرار می گیرد. داروها به احتمال زیاد هنگام جذب وحفظ MIBG 131 تداخل پیدا می کنند، که می بایست ۱ تا ۲ هفته قبل ازدرمان کنار گذاشته شوند. این داروها شامل لابتالول، رزرپین، مسدود کننده های کانال کلسیم، داروهای ضد افسردگی سه حلقه ای، سمپاتومیک و کوکائین است. بیماران باید درمورد داروی جایگزین برای خود قبل ازدرمان اقدام کنند. هدف ازدرمان با I-131 MIBG بهبود علائم و تثبیت رشد توموررا به همراه دارد، درنتیجه باعث افزایش کیفیت زندگی وطولانی ترشدن عمرمی شود. پس ازتزریق وریدی بصورت رقیق شده در۳۰ میلی لیترمحلول نرمال سالین با انفوزیون تجویز می شود که باید بصورت آهسته با زمان بیش از ۱٫۵ ساعت به بدن بیمار فرستاده شود، I-131 MIBG در خون توسط سلول های عصبی بلاستوما جذب می شود. ازآنجا که I-131 MIBG از طریق ادرار دفع می شود، بنا براین ادرار شما دربالاترین سطح تابش قرار دارد. به این دلیل که، معمولا به یک سوند ادراری متصل است، که ادرار از طریق لوله به یک جعبه سربی هدایت می شود. باقیمانده I-MIBG131 دربدن شما بعد از چند روز بعد از طریق ادرارخارج می شود. I-131 MIBG از طرق دیگر نیز از بدن خارج می شود مانند: عرق و آب دهان. فرزند شما دربخش درمان مرکزپزشکی هسته ای بستری می شود. درمان ممکن است در فواصل کمتر از ۱۲ هفته تکرارشود، که همراه با بهبود پلاکت یادآوری می شود. درموقع درمان، بیماران را باید به نوشیدن حجم زیادی ازمایعات تشویق کرد. ازآنجا که MIBG استفاده شده دارای رادیواکتیواست، شما به چند روز ماندن دربیمارستان نیازدارید، تا زمانیکه انتقال کوچکترین تابش به دیگران وجود نداشته باشد. هشدارها ی ایمنی تشعشع برای بیمار: درحالی که هیچ محدودیت قانونی درفعالیت های شما وجود ندارد، ولی توصیه می کنیم که به نکات زیرتوجه کنید. توصیه های ایمنی تشعشع به مدت یک هفته پس از درمان را دنبال کنید. هرگونه مسافرت با حمل ونقل عمومی، ازجمله مسافرت هوایی، بیش از ۲ ساعت نباید طول بکشد. اجتناب از مکان های عمومی شلوغ، سعی کنید درهرزمان ممکن یک متر با دیگران فاصله داشته باشید. با شریک زندگی در یک رختخواب نخوابید. هیچگونه تماسی با زنان باردار نداشته باشید. بازدید کنندگان بزرگسال می توانند به مدت چند دقیقه درنزدیکی بیمار باشند، اما برای طولانی مدت می بایست بیش از ۱ متر فاصله بگیرند. می توانید برای رفتن به خانه ازحمل ونقل عمومی استفاده کنید، به شرط اینکه کمتر از ۲ ساعت طول بکشد. اگرخواستید با خودروی شخصی به خانه بروید حداکثر یک نفر سرنشین باید همراه شما باشید. اگرشما درحال سفر با شخص دیگری هستید، لطفا اطمینان حاصل شود که شما درحالت مورب درمقابل وی نشسته اید. به بیماران توصیه می شود، توجه به بهداشت دقیق به منظورجلوگیری ازآلودگی به دیگران که در معرض خطر هستند را جدی بگیرند. بعد ازاستفاده از توالت دو بار سیفون را بکشید. پس ازادرارکردن بیماران باید دست های خود را حتما بشویند. به بیماران هشدارداده می شود از آلوده شدن لباس زیر و مناطق اطراف کاسه توالت تا یک هفته پس ازتزریق اجتناب کنند. به طورقابل ملاحظه ای لباس های آلوده باید به طور جداگانه شسته شوند. پس ازیک هفته شما ممکن است فعالیت های عادی خود را با اقدامات احتیاطی تابش اشعه از سربگیرید. موارد منع مصرف بصورت نسبی: بارداری یا شیردهی، امید به زندگی کمتر از ۱ ماه، HB <9، کل تعداد سلول های سفید <4.0، پلاکت <100، سرعت رو به وخامت عملکرد کلیه – GFR <30 میلی لیتر / دقیقه، مقدار Bili> 3.0، خطرغیر قابل قبول پزشکی برای جداسازی، بی اختیاری ادراری. اکثربیماران پس ازدویا سه روزترخیص می شوند. اثرات جانبی: تهوع و استفراغ موقت غیرمعمول است، اما ممکن است درطول دو روز اول پس ازپذیرش این اتفاق رخ دهد. سرکوب مغزاستخوان بصورت موقت، که معمولا حدود ۴-۵ هفته پس ازدرمان رخ می دهد و ۸-۱۲ هفته پس از درمان به سطح نرمال بازمی گردد. اثرات خونی در کودکان مبتلا به نوروبلاستوما که با I-131 MIBG تحت درمان هستند، عمدتا ترومبوسیتوپنی (شمارش پایین پلاکت) شایع است، اما دردرمان بزرگسالان با سمیت خونی بیماران شیمی درمانی به طورقابل توجهی کمتر تکرار می شود. (بدون شیمی درمانی قبلی). به ندرت تشدید نارسایی کلیه در بیمارانی که کلیه آنها به خطر افتاده است، مشاهده شده است. به ندرت دربزرگسالان مبتلا به فئوکروموسیتوم و یا پاراگانگلیوم و کودکان مبتلا به نوروبلاستوما. بحران فشارخون بالا ممکن است توسط کاتکول ها و آمین ها برانگیخته شده، ونیازبه محاصره آلفا داشته باشد. کم کاری تیروئید می تواند پس از بلوک ناکافی تیروئید دیده می شود. عوارض خونی مداوم (ترومبوسیتوپنی، سرکوب مغزاستخوان). القایی ازسرطان خون گزارش نشده است اما هرگزنمی توان آن را نادیده گرفت. دربیماران مبتلا به کارسینوئید، به علت آزاد شدن سروتونین، ممکن است گرگرفتگی رخ دهد.
درمان با لوتیشیوم-۱۷۷ DATATATE
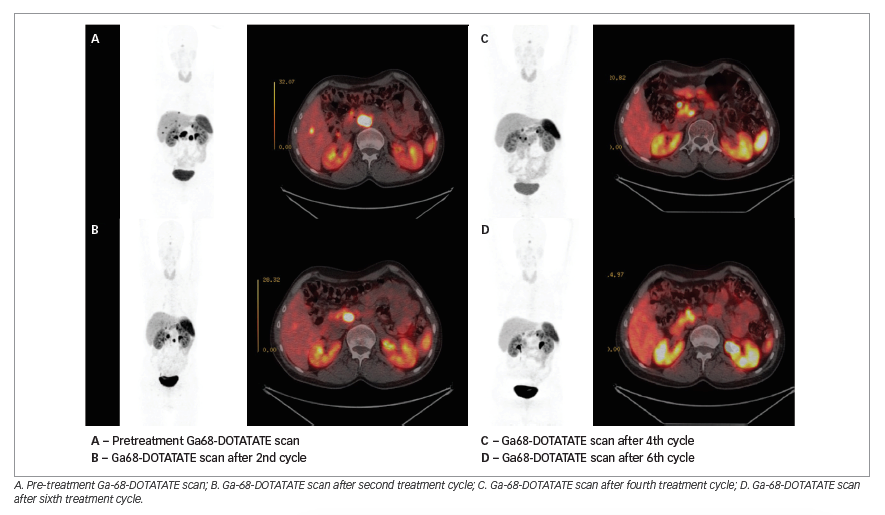
لوتشیوم دوتاتیت یک پپتید با برچسب رادیواکتیو است. این پپتید به گیرنده های خاص روی سلول متصل می شود که آن را سوماتوستاتین می نامند. مطالعات بعدی نشان خواهد داد که تومورشما این گیرنده ها را دارد. این ماده به عنوان یک انفوزیون وریدی (داخل ورید) به شما تزریق می شود و توسط تومورجذب می شود. با ترکیب دوتاتیت با رادیواکتیو لوتشیوم ، رادیواکتیویته می تواند در تومورمتمرکزشود. قبل ازاینکه شما درمان با لوتشیوم دوتاتیت را آغاز کنید، برای اینکه مطمئن شوید که این یک درمان می تواند برای شما مناسب با شد، می بایست برخی آزمایشات را انجام دهید. این آزمایشات شامل یک سری ازاسکن ها است. زمانی که شما مقداربسیارکمی ازپپتید رادیواکتیو (اکتروتاید) را بوسیله تزریق دریافت کرده باشید. اسکن، طی دو روز انجام خواهد شد و شما هر روز به ما مراجعه خواهید کرد. این آزمایشها برای این است که مقدار پپتیدی که تومور شما درطول زمان دریافت کرده، مشخص شود. برخی ازداروها می تواند با روشی که دوتاتیت در نظرگرفته، تداخل داشته باشد. داروهای شما بررسی می شوند و به شما توصیه می کنند که کدامیک از داروها را باید قبل ازدرمان استفاده یا قطع نمایید. شما باید مطمئن شوید که یک لیست کامل ازتمام داروهایی را که مصرف می کنید آماده کرده اید. لطفا هرنوع قرص وداروهایی که ازداروخانه خریداری کرده اید با خود بیاورید. لطفا داروی کافی برای مدت زمانی که اقامت دارید باخود بیاورید. اگر باردار هستید، یا حتی اگر فکر می کنید که ممکن است باردارباشید، آزمایش و درمان می بایست به تعویق بیافتد. اگرشما درحال شیردهی هستید، باید قبل ازدرمان به طورکامل متوقف شود وآزمایشهایی را که دارید به ما اطلاع دهید. همچنین ما به شما توصیه می کنیم که حداقل تا ۶ماه پس ازدرمان، باردار نشوید. اگرشما ازلنزهای تماسی استفاده می کنید، درموقع درمان نباید ازآنها استفاده کنید. درمان ازطریق یک رگ برروی بازوی شما انجام خواهد شد. علاوه براین ژلوفیوزین و اسیدهای آمینه بشکل قطره ای به بازوی شما تزریق خواهد شد. این کار برای محافظت ازکلیه های شما درمقابل اشعه است. شما همچنین داروهای ضد بیماری را دریافت خواهید کرد. تزریق مواد رادیواکتیو نیم ساعت بعد ازآغاز اسیدهای آمینه شروع می شود. تزریق حدودا نیم ساعت طول می کشد. تزریق اسیدهای آمینه و نرمال سالین بمدت سه ساعت و نیم دیگر ادامه خواهد داشت شد و پس از آن شما به اتاقتان باز می گردید. فشارخون شما درطول تزریق بررسی می شود تا مشخص شود که فشارخون شما طبیعی است. این امکان وجود دارد که شما احساس بیماری کنید. این اثرات معمولا خفیف هستند وفقط برای چند روز بوجود می آیند. لوتشیوم دوتاتیت می تواند برروی شمارش خون تاثیر بگذارد و بیشتر بیماران درجات مختلفی از کم خونی را تجربه کرده اند. سلول های سفید کم، و یا پلاکت های پایین مشاهده می شود. اقدامات احتیاطی می توانند شامل: نوشیدن مقدار زیاد مایعات و دوش گرفتن، خوردن شیرینی پس از درمان، برای جلوگیری از خشکی دهان. شستشوی لیف خود بعد ازحمام ومسواک زدن به طورکامل، کشیدن سیفون توالت دوبارپس ازاستفاده، برای جلوگیری هرگونه پاشیدگی، ازآقایان تقاضا می شود برای نظافت بیشتر بشکل نشسته ازتوالت استفاده کنند. لطفا به جای دستمال پارچه ای، از دستمال توالت استفاده کنید و بعد سیفون را بکشید. دست های خود را قبل ازخوردن غذا بشویید. اگر ادرار شما ترشح داشته باشد، بلا فاصله به بخش اطلاع دهید. اگر شما تجربه یبوست طولانی دارید، اطلاع دهید. اگرچه شما دراتاق مخصوص خود تان هستید، اما کادر درمان به طور منظم با شما درارتباط هستند. مدت زمانی که شما باید در مرکز بمانید، به میزان رادیواکتیویته باقی مانده دربدن شما و کسی که با شما زندگی می کند بستگی دارد. میانگین ماندن یک تا دو روزاست، اما ما نمی توانیم آن را تضمین کنیم .شرایط خانوادگی نیزمهم هستند. اگرشما با کودکان خرد سال زندگی می کنید، بازگشت فوری شما به خانه ممکن نیست. برای نظارت بررادیواکتیویته، ما نیازبه انجام یک سری ازاسکن برای دیدن توزیع سطح درمان دربدن شما داریم. این اسکن ها بلافاصله پس ازدرمان شما انجام خواهد شد و یک روز بعد، اسکن بعدی انجام خواهد شد. ما همچنین نیازبه انجام دو اسکن را درسه روز و شش روز را داریم. اسکن با استفاده ازیک دوربین گاما انجام می شود و بسیارشبیه به اسکنی است که قبل ازدرمان انجام داده اید.
کانسر نورواندوکرین می تواند ماهیت تهاجمی پیدا کند و قابل کنترل با درمانهای معمول (پرتودرمانی، شیمی درمانی و هورمون تراپی) نمی باشد لذا از درمانهای جایگزین همانند درمان با لوتشیوم استفاده می شود. لوتشیوم داروی ساتع کننده امواج گاما و بتا می باشد. تمام انرژی از طریق تابش بتا بین ۱ تا ۲ میلی متر در داخل بافت نفوذ دارد. که در سلولهای ناشی از سرطان پروستات تجمع پیدا کرده و باعث نابودی سلولهای سرطانی می شود. لوتیشیوم -۱۷۷ یک اتم است که ذرات رادیو اکتیو را ساطع می کند اتم لوتیشیوم که رادیو اکتیو به آن متصل است از طریق یک حامل به نام آنتی ژن اختصاصی غشاء پروستات به تومورپروستات وصل می شود. در بدن ، لوتیشیوم -۱۷۷ به سلول های خاص تومور متصل می شود و این سلول های سرطانی را از بین می برد. لوتیشیوم -۱۷۷ PSMA که توسط سلول های تومورجذب نمی شود، بوسیله عرق، بزاق، ادرار و مدفوع از بدن شما خارج می شود. این دارو در اکثر موارد موجب افزایش طول عمر بیماران، افزایش کیفیت زندگی و پسرفت بیماری شده است. درحال حاضر این شیوه نوین درمانی در مراکز معدودی در کشور از جمله موسسه پزشکی هسته ای دکتر کاظمی انجام میگردد.
- مزایای درمان چیست؟
هنگام درمان با لوتشیوم دوتاتیت، مقداری رادیواکتیو دریافت خواهید کرد. دوتاتیت یک ماده شیمیایی است. این ماده به عنوان یک انفوزیون وریدی (داخل ورید) به شما تزریق می شود و توسط تومور جذب می شود. با ترکیب دوتاتیت با رادیواکتیو لوتشیوم، رادیواکتیویته می تواند در تومور متمرکز شود. هدف این است که علائم بهبود یابد، اگرچه مدت درمان طولانی است و نتایج از فردی به فرد دیگر متفاوت است. پزشک شما درمورد خطرات، منافع وجایگزین های درمان با شما صحبت خواهد کرد. از شما درخواست خواهد شد که رضایت نامه را امضاء کنید.
- لوتشیوم دوتاتیت چیست؟
لوتشیوم دوتاتیت یک پپتید با برچسب رادیواکتیو است. این پپتید به گیرنده های خاص روی سلول متصل می شود که آن را سوماتوستاتین می نامند. مطالعات بعدی نشان خواهد داد که تومور شما این گیرنده ها را دارد. ترکیب رادیواکتیو با عواملی که سلول های خاص تومور را هدف قرارداده، روشی ابداعی است که برای درمان تومورها و گاهی اوقات به عنون درمان هدفمند شناخته شده است. لوتشیوم دوتاتیت یکی ازاین تکنیک ها است. یک پپتید یک قطعه از یک پروتئین است.
- شایعترین موارد کاربرد این رادیودارو چیست؟
Carcinoid, Gastrinoma, Glucagonoma, Insulinoma, PPoma, Somatostatinoma, Corticotrophinoma, Gonadotrophinoma, Somatotrophinoma, Thyrotrophinoma, Prolactinoma, Parathyroid adenoma, Pheochromocytoma, Ganglioneuroma, Ganglioneuroblastoma, Medulloblastoma, Neuroblastoma, Medullary thyroid carcinoma, Paraganglioma, Vasoactive Intestinal Polypeptide VIPoma, Non‐Functioning Islet Cell carcinoma.
- آیا آماده سازی برای درمان وجود دارد؟
قبل ازاینکه شما درمان با لوتشیوم دوتاتیت را آغاز کنید، برای اینکه مطمئن شوید که این یک درمان می تواند برای شما مناسب باشد، می بایست برخی آزمایشات را انجام دهید. این آزمایشات شامل یک سری از اسکن ها است، که از یک دوربین گاما استفاده می شود. زمانی که شما مقدار بسیار کمی از پپتید رادیواکتیو (اکتروتاید یا Ga-PET-CT) را بوسیله تزریق دریافت کرده باشید. اسکن، طی دو روز انجام خواهد شد وشما هر روز به ما مراجعه خواهید کرد. این آزمایشها برای این است که مقدار پپتیدی که تومورشما درطول زمان دریافت کرده، مشخص شود به عبارت دیگر پیش بینی اثر PRRT= peptide receptor radionoclide therapy.
شما به آزمایشاتی نیاز دارید که پزشک برای شما تجویز میکند که به شرح زیر است:
– آزمایش خون ۲ هفته قبل از درمان
– یک اسکن پس از درمان که توزیع همان داروی تزریق شده جهت درمان را در بدن بیمار نشان میدهد.
– آزمایش خون حدود ۶ هفته پس از درمان
– به علت اثرات رقابتی رسپتورهای سوماتواستاتین، و تداخل در درمان Lu-DOTATATE مصرف داروهای آنالوگ سوماتوستاتین کوتاه اثر ۲۴ ساعت و طولانی اثر حد اقل ۴ هفته قبل از هر نوبت درمان باید قطع شود.
Bynfezia Pen – lanreotide – Mycapssa – octreotide – pasireotide – Sandostatin – Sandostatin LAR – Signifor – Signifor LAR – Somatuline Depot
- به چند دوره درمان نیاز دارم؟
معمولاً ۳-۴ جلسه درمانی به فاصله هر ۱۲-۱۶ هفته تجویز می شود.
- در مورد داروهای من چطور؟
برخی از داروها می تواند با روشی که دوتاتیت در نظرگرفته، تداخل داشته باشد. پزشک، داروهای شما را بررسی خواهد کرد و به شما توصیه می کند که کدامیک از داروها را باید قبل ازدرمان استفاده یا قطع نمایید. شما باید مطمئن شوید که یک لیست کامل از تمام داروهایی را که مصرف می کنید آماده کرده اید.
- آیا اگر حامله یا درحال شیردهی باشم، باید اطلاع دهم؟
قبل از هر اسکن یا هر درمان این پرسش ها ازشما خواهد شد. اگر باردار هستید، یا حتی اگر فکر می کنید که ممکن است باردار باشید، آزمایش و درمان می بایست به تعویق بیافتد. اگر شما درحال شیردهی هستید، باید قبل ازدرمان به طور کامل متوقف شود. این اقدامات احتیاطی برای محافظت از کودک شما انجام خواهد شد. درمان نباید بر روی باروری شما تاثیری داشته باشد. به مردان نیز توصیه می شود که درآن زمان پدر نشوید. در ۷ روز اول درمان فعالیت جنسی ممنوع است. آگر از نظر جنسی فعال هستید بسیارمهم است که کنترل موثر تولد یا کنتراسپشن پس از درمان را (۷ ماه برای آقایان و ۴ ماه برای خانم ها) بکار ببندید.
- آیا هر گونه خطری برای خانواده و یا دوستان من وجود دارد؟
در این نوع درمان اشعه ساطع شده از رادیو دارو در درون بدن باقی میماند و فقط مقادیر بسیار کمی از اشعه از بدن خارج می شود. پس از خروج از مرکز، خانواده و دوستانتان در معرض خطر نیستند اما برخی اقدامات احتیاطی را توصیه می کنیم:
– تا یک هفته پس از درمان، همیشه سیفون توالت را پس از استفاده دو بار بکشید.
– خودداری از هر گونه تماس با کودکان و زنان باردار به مدت ۳ روز
– محدود کردن تماس نزدیک با دیگر بزرگسالان به مدت ۳ روز
– اجتناب از به اشتراک گذاری تخت با شخص دیگری به مدت ۳ روز
- چه چیزهای دیگری نیازاست که بدانم؟
اگرشما از لنزهای تماسی استفاده می کنید، درموقع درمان نباید از آنها استفاده کنید. لطفا برخی از عینک ها را با خود بیاورید.
- در روز پذیرش، روند درمان چگونه می باشد ؟
فرایند درمان از طریق تزریق مقدار کمی از دارو و در طی چند دقیقه انجام می شود. پس از آن، بیمار برای چند ساعت در اتاقی که بدین منظور و با استانداردهای لازم لحاظ گردیده است، نگهداری می شود تا مقدار عمده ماده رادیواکتیو از طریق ادرار از بدن وی دفع گردد. در طول مدت بستری نیز مقداری مایع از طریق رگ برای دفع سریعتر اشعه داده می شود. در روزهای پس از درمان و جهت ارزیابی جذب رادیو دارو برای بیمار، اسکن بعد از درمان (Post Treatment Imaging) انجام می شود.
- درمان چگونه انجام می شود؟
درمان از طریق یک رگ بر روی بازوی شما انجام خواهد شد. علاوه براین ژلوفیوزین واسیدهای آمینه بشکل قطره ای به بازوی شما تزریق خواهد شد. این کار برای محافظت از کلیه های شما درمقابل اشعه است. شما همچنین داروهای ضد بیماری را دریافت خواهید کرد. تزریق مواد رادیواکتیو نیم ساعت بعد از آغاز اسیدهای آمینه شروع می شود. تزریق رادیواکتیو حدودا ۳۰ دقیقه طول می کشد. تزریق اسیدهای آمینه و نرمال سالین بمدت سه ساعت و نیم دیگر ادامه خواهد داشت شد و پس از آن شما به مطب پزشکی هسته ای باز می گردید. فشارخون شما درطول تزریق بررسی می شود تا مشخص شود که فشارخون شما طبیعی است.
- چه اقدامات احتیاطی را باید انجام بدهم؟
نوشیدن مقدار زیاد مایعات و دوش گرفتن. خوردن شیرینی پس از درمان، برای جلوگیری از خشکی دهان. شستشوی لیف خود بعد از حمام و مسواک زدن به طورکامل. کشیدن سیفون توالت دو بار پس از استفاده. برای جلوگیری هرگونه پاشیدگی، از آقایان تقاضا می شود برای نظافت بیشتر بشکل نشسته از توالت استفاده کنند. لطفا به جای دستمال پارچه ای، از دستمال توالت استفاده کنید و بعد سیفون را بکشید. دست های خود را قبل از خوردن غذا بشویید.
- چه مدت طول خواهد کشید تا مواد رادیواکتیویته از بدن خارج شود؟
در بیماران به منظور جلوگیری از بروز آلودگی سونداژ انجام می شود در پایان سونداژ و کیسه ادرار جهت اقدامات حفاظتی در بخش پسمانداری مرکز نگهداری می گردد. در طول ۱۲ساعت پس از درمان مقدارزیادی از مواد رادیواکتیویته از طریق ادرار از بدن شما خارج می شود و باید احتیاط شود. لوتشیوم دوتاتیت به تدریج در بدن شما ناپدید می شود، که به طور عمده در ادرار است. همچنین، رادیواکتیویته باقی مانده در داخل بدن شما هر روز کاهش خواهد یافت. مدت زمان برای ناپدید شدن رادیواکتیو در بدن، در افراد متفاوت است. ما در طول درمان میزان رادیو اکتیو شما را به طور منظم اندازه گیری می کنیم تا ببینیم که چه مقدار رادیواکتیو از بدن شما خارج شده است. ما قادر خواهیم بود که زمان رفتن شما را به خانه و محدودیت هایی را که باید دنبال کنید، پیش بینی کنیم.
- آیا ممکن است که ملاقاتی داشته یاشم؟
با توجه به برخی محدودیت ها بعد از درمان، شما نباید با افراد دیگر تماس نزدیک داشته باشید. هیچکس در روز درمان اجازه ملاقات با شما را ندارد. مقدار فضای بین شما و بازدید کنندگان باید حداکثر باشد. شما نباید هیچگونه تماس فیزیکی با بازدید کنندگان خود داشته باشید، یا غذا و نوشیدنی از دست آنها بگیرید و یا نباید از غذا ها و نوشیدنی های شما استفاده کنند. این موضوع مهمی است که درطول این مدت، کودکان زیر ۱۸ سال و زنان باردار اجازه همراهی را ندارند.
- چگونه می توانم به خانه بروم؟
به طورکلی، شما می توانید با ماشین شخصی یا تاکسی به خانه بروید، البته بدون حضور کودکان و زنان باردار. شما ممکن است قادربه رفتن به خانه با حمل ونقل عمومی باشید، که بازهم، بستگی به میزان رادیواکتیویته وهمچنین طول سفر شما دارد. ترجیحا با حمل و نقل عمومی به خانه نروید.
- چگونه باید درخانه رفتار کنم؟
از تماس نزدیک با افراد دیگر، بخصوص با کودکان و زنان باردار خودداری کنید. عدم تماس با کودکان. به حداقل رساندن تماس با حیوانات خانگی. بعد ازمراجعت به منزل، از رفتن به مکان های عمومی مانند مغازه، سینما، خانه های عمومی و حمل و نقل عمومی خودداری نمایید. اگر امکان دارد تنها بخوابید. از بوسیدن و فعالیت جنسی خودداری نمایید. پس از استفاده از توالت دو بارسیفون بکشید و دست های خود را به طورکامل بشویید و آبکشی کنید. اگرشما به دو توالت دسترسی دارید فقط از یکی از آنها استفاده کنید. مطمئن شوید که هیچ شخص دیگری از حوله و دستمال صورت شما استفاده نمی کند. شستن حوله و لباس زیر خود به طور جداگانه. تمیز بودن حمام راه اصلی برای جلوگیری از آلوده شدن افراد دیگر است.
- چه موقع می توانم به محل کارخود برگردم؟
اگر کار شما با کودکان باشد، به عنوان مثال: معلم و یا پرستار باشید. تماس نزدیک با زنان باردار در محل کار داشته باشید. کارشما درصنعت آماده سازی مواد غذایی باشد. اگر فکر می کنید که مقدار کمی از اشعه ممکن است محیط کار شما را تحت تاثیر قرار دهد. لطفا به ما اطلاع دهید، ضمن اینکه ممکن است شما تا مدتی کمی طولانی دور از محل کار بمانید.
- آیا من به اسکن و یا درمان دیگری نیاز دارم ؟
برای نظارت بر رادیواکتیویته، ما نیاز به انجام یک سری از اسکن برای دیدن توزیع سطح درمان دربدن شما داریم. این اسکن ها بلافاصله پس از درمان شما انجام خواهد شد و ۲۴ ساعت بعد، اسکن بعدی انجام خواهد شد. ما همچنین نیاز به انجام دو اسکن را در سه روز و شش روز بعد را داریم.
- درمان لوتشیوم DOTATATE چگونه انجام می شود؟
این درمان از طریق تزریق آهسته داخل وریدی در طی یک ساعت انجام می شود. همچنین یک محلول مایع حاوی اسیدهای آمینه (پروتئین) را از طریق تزریق آهسته دیگری طی ۴ ساعت دریافت خواهید کرد تا کلیه های شما را از اثرات احتمالی اشعه محافظت کند.
- آیا قبل از درمان نیاز به آمادگی خاصی وجود دارد؟
خیر، نیازی به انجام اقدامات احتیاطی خاصی نیست. با این حال، اگر قبل از تاریخ درمان احساس ناراحتی می کنید، لطفا کارشناسان را مطلع کنید.
- آیا در صورت بارداری یا شیردهی می توانم این درمان را دریافت کنم؟
خیر. زنان باردار یا شیرده نباید تحت درمان قرار بگیرند. شیر دهی ۲٫۵ ماه بعد از آخرین سیکل درمان می تواند ادامه یابد.
- آیا اثرات جانبی دارد؟
بیشترین گزارش، حالت تهوع است، اما قبل ازدرمان برای جلوگیری ازتهوع ما به شما دارو می دهیم البته اگر لازم باشد و همچنین قرص هایی که بعد ازآن در منزل مصرف کنید.
- دیگر اثرات جانبی به شرح زیر است:
– افت گلوبولهای قرمز و سفید و پلاکتها به صورت گذرا
– ریزش مو بشکل گذرا
– احساس خشکی دهان به علت کاهش عملکرد غدد بزاقی
– کاهش در عملکرد کلیه بویژه در افراد با سابقه بیماری کلیه
– خستگی
– بروز تهوع و خستگی در یک هفته اول بیماری
مطلب مرتبط با اسکن تمام بدن: اسکن MIBG
مطلب مرتبط با اسکن تمام بدن: اسکن گیرنده سوماتوستاتین
این رادیو دارو در درمان سرطان تیروئید و پر کاری تیروئید مقاوم به درمان دارویی، کاربرد گسترده ای دارد و بر اساس مطالعات انجام شده در ۶۰ سال گذشته، عارضه جانبی قابل اهمیتی از آن مشاهده نشده است. قبل از تجویز ید، از بیمار خواسته می شود که به مدت ۴ ساعت ناشتا باشد و مصرف داروهای خاص را نیز قطع کند.
ید رادیواکتیو برای درمان سرطان تیروئید از قدیمی ترین و درمانی ترین ،ید است که برای درمان سرطان تیروئید تثبیت، وهمچنین برای طیف وسیعی از بیماری های خوش خیم تیروئید استفاده می شود. این درمان ها به خوبی وبا میزان موفقیت بالا تثبیت شده است.
درمان ید رادیواکتیو چیست؟
ید رادیواکتیو به عنوان یک رادیو دارو یکی از قدیمی ترین و موفق ترین درمان رادیونوکلئید ارائه شده در سراسر جهان است. جذب طبیعی تیروئید به ید اجازه می دهد تا درمان تیروئید که غیر تهاجمی است با استفاده از ید رادیواکتیو بسیار هدفمند. ید رادیواکتیو دارای ویژگی های همان ید موجود در مواد غذایی؛ با این حال با ید رادیواکتیو تابش است که آسیب رساندن به بافت را ساطع می کند. با ید رادیواکتیو است که معمولا به عنوان یک کپسول، بزرگتر از یک قرص پاراستامول معمولی داده شده است. همچنین می تواند به عنوان مایع مخلوط شده با آب تجویز شود. هنگامی که در جریان خون، تیروئید با ید رادیواکتیو برای تولید هورمون های T3 و T4 جذب می کند. تابش که توسط فرسایش ید رادیواکتیو (از بین می برد) به بافت اطراف آن داده می شود، تا زمانی که توسط تیروئید جذب می شود، آن را قادر به ارائه پرتو را به هدف محدود می سازد.
تیروئید قادر به جذب تمام ید رادیواکتیو به عنوان یک ظرفیت محدود نیست . این است که چرا قبل از هر درمان با ید رادیواکتیو، یا یک رژیم غذایی کم ید و یاتزریق لازم است برای افزایش تحریک کننده تیروئید هورمون (TSH) برای حداکثر جذب از ید رادیواکتیو در زمان دو تیروئید قادر به جذب تمام ید رادیواکتیو به عنوان یک ظرفیت محدود نیست. این که چرا قبل از هردرمان با ید رادیواکتیو، یا یک رژیم غذایی کم ید و یاتزریق برای افزایش تحریک کننده تیروئید هورمون (TSH) برای حداکثر جذب از ید رادیواکتیو، زمان لازم است. تیروئید ی که ید جذب نمی کند به خارج از خون فیلتر شده و دفع عمدتا از نه طریق ادرار، بلکه از طریق سایر مایعات بدن مانند عرق و بزاق انجام می شود. به منظور به حداقل رساندن تابش اشعه به دیگرقسمت های بدن بیماران، تقاضا به نوشیدن مقدار زیادی مایعات و همچنین ادرار کردن ودوش به طور منظم می شود.
مشاوره حفاظت از اشعه بسته به اندازه تجویز دوز، شامل اقدامات احتیاطی اما معمولی است که متفاوت می باشد.
– نزدیک (کمتر از طول بازو) و طولانی مدت (بیشتر از ۱۰ دقیقه) در تماس با کودکان زیر شش سال و زنان باردار به مدت هشت روز
– نزدیک (کمتر از طول بازو) و طولانی مدت (بیشتر از ۱۰ دقیقه) با بزرگسالان در تماس منظم (به عنوان مثال دوستان نزدیک، اعضای خانواده) به مدت سه روز
– به اشتراک گذاری تخت به مدت پنج روز
این اقدامات احتیاطی به طور معمول می تواند به یک برنامه روزانه بدون مانع بسیار خوب تبدیل شود.
یک فیزیکدان پزشکی می تواند اقدامات احتیاطی معمول قبل از درمان را تجویز کند.
پروتکل تیروژن:
درمان قطع شیردهی در بیماران قبل از دریافت کننده ید رادیواکتیو:
از آگونیست دوپامین مانند قرص Cabergoline توصیه می شود (مجموعا” چهار عدد قرص) استفاده کنید:
- یک عدد امروز و یک عدد فردا
- یک هفته بعد هم مجددا” یک قرص در دو روز متوالی
دو ماه پس از قطع کامل شیردهی، بیمار را با قطع لووتیروکسین و در صورت لزوم تزریق تیروژن آمادگی بدهید و با تایید TSH بالای ml/mIU30 ید را تجویز فرمایید.
مشاوره حفاظت از اشعه بسته به اندازه تجویز دوز دریافتی، زمان و فاصله مجاز از اطرافیان متفاوت می باشد.
مطلب مرتبط با اسکن سر و گردن: اسکن تیروئید
کاربرد رادیودارویI-131 MIBG در درمان تومورهای با منشا غددی- عصبی، خصوصا از نوع نورواکتودرمال (سمپاتوآدرنال) شامل فئوکروموسیتوم، پاراگانگلیوم و نوروبلاستوم موثر بوده است. در سایر تومورهای غددی- عصبی (عمدتا کارسینوئید و کارسینوم مدولاری تیروئید) نیز این درمان گاهی می تواند موثر واقع گردد. استفاده ازI-131 MIBG برای تومورهای فئوکروموسیتوم و پاراگانگیوم کارآمدترین روش درمان غیرجراحی است، زیرا علاوه بر افزایش امید به زندگی، علایم بیمار را نیز به طور قابل ملاحظه ای (۹۰-۷۵ درصد) کنترل می کند. در نوروبلاستوم اگرچه در موارد با عود مکرر و مقاوم به درمان ۳۰ درصد تاثیر درمانی داشته است، اما با افزودن سایر مودالیتی های درمانی به این نوع درمان، موفقیت بیشتری به دست می آید، ضمن این که I-131 MIBG در کنترل علایم نیز موثر بوده است. برای سایر تومورهای غددی- عصبی شامل تومور کارسینوئید و کارسینوم مدولاری تیروئید اثرات این درمان در کاهش علائم بیمار مشاهده شده است. مهم ترین عارضه این درمان مهار مغز استخوان است که نیاز به پیگیری و درمان در صورت لزوم دارد I-131 MIBG نقش مهمی در درمان تومورهای کرومافینی دارد و برای تومورهای فئوکروموسیتوم و پاراگانگیوم کارآمدترین درمان غیرجراحی است.
درمان دردهای استخوانی با استرانسیوم ۸۹ (متاسترون) و ساماریوم ۱۵۳
یکی از عوارض ناتوان کننده بدخیمی ها، متاستازهای استخوانی و درد ناشی از آن است که بیشتر در سرطان پروستات و پستان دیده می شود. در کشورهای پیشرفته، یکی از درمان های رایج برای کاهش درد در متاستازهای گسترده استخوانی، استفاده از رادیو داروها نظیر استرانسیوم ۸۹ یا ساماریوم ۱۵۳می باشد. این درمان نیاز به بستری نداشته و به صورت سرپایی قابل انجام است. قبل از درمان، انجام اسکن استخوان جهت بررسی شدت و وسعت درگیری استخوانی لازم است. در حال حاضر در کشور ما علاوه بر متاسترون درمان با ساماریوم ۱۵۳ با هزینه کمتر و اثرات کاملاً مشابه در دسترس می باشد.
لازم به ذکر است که درمان درد های استخوانی با این رادیوایزوتوپها نیاز به بررسیهای اولیه خاصی داشته که توسط پزشک انجام می شود. پس از تجویز رادیودارو در ابتدا ممکن است دردهای بیمار بیشتر شود و سپس کاهش یابد.
مطلب مرتبط با اسکن تمام بدن: اسکن تمام بدن استخوان
این رادیو دارو در درمان سرطان تیروئید و پر کاری تیروئید مقاوم به درمان دارویی، کاربرد گسترده ای دارد و بر اساس مطالعات انجام شده در ۶۰ سال گذشته، عارضه جانبی قابل اهمیتی از آن مشاهده نشده است. قبل از تجویز ید، از بیمار خواسته می شود که به مدت ۴ ساعت ناشتا باشد و مصرف داروهای خاص را نیز قطع کند.
مطلب مرتبط با اسکن سر و گردن: اسکن تیروئید
سینوویورتز رادیواکتیو که با تزریق رادیوایزوتوپهای بیضرر به داخل مفاصل مبتلا به آرتریت مزمن صورت میگیرد، از جمله روشهای جدید در درمان آرتروپاتی هموفیلیک محسوب میگردد. این روش درمانی که با هدف اولیه کاهش همارتروز و مصرف فاکتور انعقادی به کار رفته است، میتواند تاثیر بهسزایی در بهبود کیفیت زندگی و کاهش بار اقتصادی ناشی از مصرف فاکتور انعقادی داشته باشد. سینوویورتز با فسفر رادیواکتیو، میتواند روشی مؤثر و به صرفه در کاهش همارتروز و مصرف فاکتور در بیماران مبتلا به آرتروپاتی هموفیلیک باشد.
مطلب مرتبط با اسکن تمام بدن: اسکن استخوان سه فاز
درمان متازستازهای کبد با امبولیزاسیون شریان تغذیه ای تومور
میکروسفرها
میکروسفرها، حوزه های رزین های کوچک است که حاوی صدها ذرات رادیونوکلئید هستند، که یک سبک درمانی براکی تراپی رادیونوکلئید است که برای درمان سرطان های کبد ایجاد شده است. ماهیت نتایج درمان نشان دهنده یک درمان مفید با کمترین هزینه برای عملکرد کبد است.
میکروسفرها چه هستند؟
میکروسفرها حوزه رزین که هر یک شامل میلیون ها اتم رادیواکتیو، یا (ایتریم-۹۰) می باشد. اتم های رادیواکتیو تابش کوتاه برد منتشر می کنند. هر یک از حوزه ها شامل میلیون ها اتم رادیواکتیو هستند، که حوزه با دوز تابش بالا به یک محدوده کوچک در مناطق اطراف آن است.
چگونه کار می کند؟
این روش شامل ساخت یک برش کوچک در کشاله ران تحت بی حسی موضعی، و عبورکاتتر قابل انعطاف (لوله)، به شریان کبدی از طریق شریان فمورال و سلیاک است. منابع شریان کبدی بیشترین خون را برای تومورهای کبد، با ارائه مستقیم به شریان کبدی برای اهداف انتخابی می فرستند، که با تنها درصد کمی (۱۰-۲۰٪) به بافت کبد سالم آسیب می رساند.
مداخله رادیولوژیست ممکن است برای عرضه بیشترخون از بافت کبد سالم با عبور از کاتتر به شریان کبدی چپ یا راست باشد که به شاخه های شریان اصلی کبد منجر خواهد شد. اگرتومور کبد به لوب سمت چپ یا راست کبد محدود شده باشد.
میکروسفرها ازطریق کاتتر اداره می شوند و سفر درامتداد شریان کبدی و عروق خونی کوچک واقع در اطراف سطح تومورادامه می یابد. میکروسفرها نسبتا بزرگ هستند، آنها در مویرگها تعبیه شده و مقدار زیادی از اشعه به منطقه مورد ۲-۳mm در اطراف جایی که تومورها به دام افتاده اند می فرستند. در نتیجه، هدف قراردادن تومورها ی انتخابی ، با ارائه یک دوزاز تابش بالااست، در حالی که به حداقل رساندن دوز به بافت کبد طبیعی است.
چگونه درمان تجویز می شود؟
درمان توسط دو رادیولوژیست و متخصص طب هسته ای با تجربه تایید شده برای انجام این روش است و هر دو توسط یک تیم مجرب از فیزیکدانان پزشکی، رادیولوژی، و پرستاران پشتیبانی می شوند. درمان در دو جلسه اتفاق می افتد، اولین ارزیابی قبل از درمان و در جلسه دوم، معمولا ۲ هفته بعد انجام می شد، که تحویل میکروسفرها است.
قبل از روز درمان
در روز قبل از درمان، شما دو روش تحت عنوان آنژیوگرام و اسکن پزشکی هسته ای را خواهید داشت.
آنژیوگرام یک تصویر دقیق از جزییات جریان خون به کبد را نشان می دهد، که می تواند بین افراد متفاوت باشد. قبل از آنژیوگرافی، کشاله ران با یک بی حسی موضعی بی حس و یک برش کوچک بوجود می آورند.
و سپس از طریق ، کاتتر (لوله) نرم انعطاف پذیر روی برش قرار داده و به شریان کبدی از طریق شریان فمورال (به طوری که کاتتر گاهی اوقات یک کاتتر فمورال نامیده می شود) فرستاده می شود. هنگامی که کاتتر را در محل قرار می دهند یک ماده حاجب (رنگی) است که از طریق لوله تزریق می شود تصاویر رگهای خونی با استفاده از اشعه ایکس.
یک ردیاب رادیواکتیو که تکنتیوم ۹۹m-MAA نامیده می شود، به برشی که در شریان کبدی قرار گرفته است تزریق می شود. این ردیاب رادیواکتیو یک ردیاب کم انرژی است که از رادیواکتیو میکروسفرها ی SIR با انرژی بالا تقلید می کند.
ازکبد و ریه که با یک دوربین گاما تصویربرداری شده که به تشخیص ردیاب با انرژی پایین به تیم پزشکی اجازه می دهد محل میکروسفرها را در روز درمان پیش بینی کند. این روش معمولا درحدود ۶۰-۹۰ دقیقه طول می کشد، اما ممکن است در برخی از مواردبیشتر شود. این معمولا شامل ناراحتی شما و یا ممکن است احساس گرما یا احساس سوزش خفیف هنگامی که ماده حاجب (رنگی) تزریق می شود داشته باشید. سخت ترین قسمت در این روش ممکن است دراز کشیدن به شکل صاف باشد. بعد از این روش، شما می توانید یک رژیم غذایی طبیعی داشته باشید و تمام فعالیت های عادی را درعرض ۸ تا ۱۰ ساعت از سر بگیرید.
به دنبال روش آنژیوگرافی، شما به پزشکی هسته ای برای اسکن منتقل خواهید شد. اسکن شامل با یک دوربین گاما که به تشخیص مقدار کمی ازاشعه که توسط MAA داده می شود و یک کامپیوتربرای تعیین مقدار و محل MAA جذب شده توسط بدن می شود. گاهی اوقات MAA را از طریق کبد به ریه منتقل میشود. دکتر شما باید بداند که چه مقدار از MAA با یک دوز ایمن میکروسفرهای SIR از کبد شماعبور می کند.
روز درمان
در روز درمان شما نیاز به آنژیوگرام دیگری دارید. این آنژیوگرام دوباره نیاز به یک برش کوچک در ناحیه کشاله ران با یک بی حسی موضعی دارد، به طوری که کاتتر را می توان به شریان کبدی متصل کرد. این آنژیوگرام معمولا سریعتر از درمان قبل عمل می کند. در اینجا رادیولوژیست برای شناسایی بهترین مکان برای کاتتر مداخله می کند. هنگامی که قرار دادن کاتتر تایید شد، می توان میکروسفرها را انتقال داد. این کار حدود ۱۵-۲۰ دقیقه طول می کشد. یک آرام بخش برای کمک به تسکین درد، به شما داده خواهد شد. اگر شما به آن نیاز داشته باشید. پس از عمل و تحویل میکروسفرها ،. یک پانسمان کوچک روی برش در ناحیه کشاله ران شما قرار می گیرد و فشار به محل مورد نظر برای ۱۰-۱۵ دقیقه اعمال می شود. ازشما خواسته می شود که در حدود ۴ ساعت برای جلوگیری از خونریزی دراز بکشید . بعد از آن روز و یا صبح روز بعد، شما یک اسکن پزشکی هسته ای دیگر برای قرار دادن میکروسفرها را خواهید داشت. این روش در کل ازابتدا تا انتها حدود یک ساعت طول می کشد.
حفاظت در برابر اشعه
میکروسفرها تنها برای مدت زمان محدود در رادیواکتیو باقی می مانند. پس از دو هفته بخش بسیار کوچکی از تابش اولیه باقی می ماند و بعد از ۱ ماه از تابش برای تبدیل شدن غیر قابل کشف است. میکروسفرها ی رزین در کبد به طور دائم باقی می ماند. آنها بی ضرر هستند. پیش از ترخیص، یک فیزیکدان پزشکی شما را با ارائه کاتولوگ و توضیح اقدامات احتیاطی خاص که باید انجام شود که به حداقل رساندن خطر تابش به دیگران است راهنمایی می کند. به طور معمول،به دلیل تابش کوتاه برد و طول عمر کوتاه، این اقدامات احتیاطی به حداقل رساندن (کمتر از طول بازو) و طولانی مدت (بیشتر از ۱۰ دقیقه) تماس با همکاران و یا کودکان خردسال برای هفته اول پس از آن تجویز می شود. این اقدامات احتیاطی به طور معمول می تواند به یک برنامه روزانه بدون مانع بسیار خوب تبدیل شود. یک فیزیکدان پزشکی می تواند اقدامات احتیاطی معمول قبل از درمان را مورد بحث و بررسی قرار دهد.
این رادیو دارو در درمان برخی از انواع سرطان های خون که مقاوم به درمان های دارویی هستند یا عودهای مکرر دارند، بکار می رود. این روش فاقد عوارض جانبی مانند تهوع، استفراغ سرکش و ریزش مو می باشد. برای انجام درمان با زوالین، قطع مصرف برخی از داروها توصیه می شود.
تشخیص و درمان لنفوم فولیکولار
به سرطانی شدن لنفوسیت ها لنفوم می گویند. لنفوسیت یکی از انواع سلول های سفید خون می باشد که از طریق شبکه ای به نام سیستم لنفاوی در بدن گردش می کند. این سیستم شامل مغز استخوان، طحال، تیموس . غدد لنفاوی می باشد. ارگان ها و عروق لنفاوی با همکاری یکدیگر سلول هایی را تولید و ذخیره می کنند که این سلول ها وظیفه دارند با عفونت مقابله کنند.
دو نوع لنفوم وجود دارد:
– لنفوم هوچکین (HL)
– لنفوم غیر هوچکین (NHL)
لنفوم غیر هوچکین شایع ترین نوع لنفوم می باشد. لنفوم فولیکولار یکی از انواع NHL می باشد که برخلاف سایر انواع NHLها معمولا رشد آهسته ای داشته و ممکن است تا چندین سال احتیاج به درمان نداشته باشد.
در این بخش به فاکتورهای خطرساز، طبقه بندی، علائم و درمان لنفوم فولیکولار پرداخته می شود.
فاکتورهای خطرساز لنفوم فولیکولار:
سن، جنسیت و نژاد فرد در احتمال ابتلای او به لنفوم فولیکولار تاثیر گذار است. تمایل ایجاد این لنفوم در خانم ها اندکی بیشتر از مردان می باشد و در آسیایی ها و سیاه پوستان در مقایسه با نژادهای دیگر کمتر است. این لنفوم در بزرگسالان دیده می شود و میانگین سن ابتلا به آن ۶۰ سال می باشد.
علائم لنفوم فولیکولار:
اولین علامت لنفوم فولیکولار تورم یک یا چند غده ی لنفاوی بدون درد مخصوصا در ناحیه ی گردن، زیر بغل و یا کشاله ی ران می باشد. اغلب افراد مراجعه کننده با لنفوم فولیکولار از تورم طولانی مدت غدد لنفاوی شکایت دارند. قبل از شروع درمان اندازه ی این غدد لنفاوی ممکن است چندین بار افزایش یا کاهش یابد.
برخی از افراد مبتلا به لنفوم فولیکولار ممکن است توده ای را نیز در شکم خود احساس کنند. این تومور ممکن است علامتی نداشته باشد اما ممکن است سبب ایجاد انسداد در سیستم گوارشی، ادراری یا عروق خونی شود.
تشخیص و مرحله بندی لنفوم فولیکولار:
تشخیص لنفوم فولیکولار با انجام بیوپسی و برداشتن بخشی از غده ی متورم و بررسی آن در زیر میکروسکوپ تایید می شود.
پس از قطعی شدن تشخیص، آزمایش های بیشتری برای تعیین میزان تهاجم و انتشار بیماری در بدن انجام می شود. این روند، مرحله بندی نامیده می شود که در تعیین نحوه ی درمان کمک کننده خواهد بود.
شرح حال و معاینه ی فیزیکی:
معاینه ی فیزیکی دقیق در تعیین میزان گسترش بیماری کمک کننده می باشد. این معاینه می تواند غدد لنفاوی متورم را در نقاط مختلف بدن مشخص کند.
آزمایش های تعیین مرحله ی بیماری:
چندین آزمایش برای مشخص کردن نواحی از بدن که با لنفوم فولیکولار درگیر شده اند، وجود دارد که می توانند شامل موارد زیر باشند:
– تست های خونی
– بیوپسی از مغز استخوان (برداشتن نمونه ی کوچکی از بافت مغز استخوان و بررسی آن)
CT – اسکن
PET – اسکن
اصطلاحات مرحله بندی:
اصطلاحات زیر در مرحله بندی لنفوم کاربرد دارند:
منطقه ی غدد لنفاوی: غدد لنفاوی موجود در یک ناحیه به همراه بافت اطراف آن را می گویند مانند غدد لنفاوی گردنی در ناحیه ی گردن، آگزیلاری در زیر بغل، اینگوئینال در کشاله ی ران یا مدیاستینال در قفسه ی سینه.
ساختارهای لنفاوی: ارگان ها یا ساختار هایی که بخشی از سیستم لنفاوی بدن می باشند. مانند غدد لنفاوی، طحال و تیموس
دیافراگم: عضله ی بزرگی که حفره ی شکم را از فضای قفسه ی سینه جدا می کند.
مرحله بندی: مرحله بندی شامل تقسیم بیماران به گروه هایی ست که بر مبنای میزان درگیری سیستم لنفاوی در هنگام تشخیص انجام می شود. مرحله بندی به تعیین پیش آگهی و گزینه های درمانی بیمار کمک می کند.
مراحل لنفوم:
مرحله ۱: تنها غدد لنفاوی یک ناحیه یا یک ساختار لنفاوی درگیر باشد.
مرحله ۲: تعداد ۲ یا بیشتری از نواحی یا ساختارهای لنفاوی یک طرف دیافراگم درگیر باشد.
مرحله ۳: نواحی یا ساختارهای لنفاوی در دو طرف دیافراگم درگیر باشد.
مرحله ۴: ارگان ها یا بافت های دیگری غیر از نواحی یا ساختارهای لنفاوی مانند مغز استخوان درگیر باشد.
هنگامی که مرحله ی بیماری مشخص شد با توجه به این که بیمار تب، کاهش وزن یا عرق شبانه داشته باشد از حروف A یا B نیز به همراه این مراحل استفاده می شود. A به معنای عدم بروز و B به معنای بروز این علائم می باشد. به عنوان مثال فردی که با مرحله ی ۱B لنفوم مراجعه کرده باشد به معنای این است که یک منطقه ی لنفاوی در این فرد درگیر شده و او علائم B را بروز داده است.
پیشرفت لنفوم فولیکولار:
سیر پیشرفت لنفوم فولیکولار بسته به سرعت رشد تومور و ارگان های درگیر دیگر، در افراد مختلف می تواند متفاوت باشد. در برخی از افراد تا چندین سال ممکن است احتیاجی به درمان نباشد. در برخی دیگر ممکن است با بروز غلائم درمان شروع شود. این علائم می توانند شامل تب، عرق شبانه، کاهش وزن، درد، انسداد ارگان ها، کم خونی (آنمی) با تغییرات خونی دیگر باشد.
در برخی از افراد لنفوم فولیکولار ممکن است به لنفوم تهاجمی دیگری مانند DLBCL تبدیل شود که رشد سریعی داشته و احتیاج به مداخله ی درمانی فوری دارد.
درمان لنفوم فولیکولار:
درمان لنفوم فولیکولار به علائم بیماری، درجه ی تومور، سن و وضعیت سلامتی عمومی فرد بستگی دارد. اکثر افرادی که با این لنفوم مراجعه می کنند بیماری گسترش یافته ای دارند اما از آنجایی که لنفوم فولیکولار رشد آهسته ای دارد ممکن است زمان زیادی برای پیشرفت بیماری احتیاج باشد و در این دوره درمانی برای بیمار احتیاج نباشد. وقتی که علائم بیماری هنوز بروز نیافته باشد و ارگان های دیگر درگیر نشده باشند به نظر نمی رسد که درمان اولیه ی لنفوم فولیکولار بقای بیمار را بهبود بخشد. بنابراین توصیه می شود در این مرحله بیمار تحت مراقبت های دقیق واقع شود.
به علاوه آهسته بودن رشد این نوع از لنفوم پاسخ به درمان آن را کم می کند به همین دلیل اغلب این بیماری به طور کامل قابل معالجه نیست و هدف اصلی از درمان آن بهبود علائم بیمار می باشد.
ویژگی هایی که موجب می شود بیمار تحت درمان قرار گیرد می تواند شامل موارد زیر باشد:
-تورم پیشرونده ی غدد لنفاوی
– تب، کاهش وزن یا عرق شبانه
– افت سلول های خون
افرادی که علائم فوق را نداشته باشند معمولا با معاینه و آزمایش خون مرتب تحت نظر قرار می گیرند.
مراحل اولیه ی بیماری:
برخی از بیمارانی که با مرحله ی یک یا دو لنفوم فولیکولار مراجعه می کنند ممکن است با پرتو درمانی تنها درمان شوند.
پرتو درمانی: در پرتو درمانی از اشعه ی X پرانرژی برای توقف یا کاهش رشد سلول های سرطانی استفاده می شود. پرتو به غدد لنفاوی درگیر تابانده می شود. ممکن است غدد لنفاوی مجاور آنها نیز درمان شود. پرتو درمانی طی چند هفته و با دوز روزانه ی کم درمان می شود تا عوارض جانبی درمان بالا نرود. تعداد هفته های درمانی به دوز تجویزی پزشک بستگی دارد.
مرحله ی پیشرفته ی بیماری:
این مرحله شامل مراحل ۳ و ۴ لنفوم فولیکولار می باشد. گاهی اوقات مرحله ی ۲ لنفوم نیز به عنوان مرحله ی پیشرفته تلقی می شود.
گزینه های درمانی زیادی برای مرحله ی پیشرفته ی لنفوم فولیکولار وجود دارد. انتخاب نوع درمان به نظر بیمار و وضعیت بیماری فرد بستگی دارد. اکثر بیماران با این مرحله ی بیماری با داروی Rituximab و شیمی درمانی، درمان می شوند. برای بیماران مسن تری که علام بیماری را بروز داده اند اما نشانه ای از انسداد ارگان در آنها دیده نمی شود معمولا ایمنی درمانی با Rituximab توصیه می شود.
درمان با آنتی بادی: Rituximab یک آنتی بادی ست که برای درمان لنفوم فولیکولار استفاده می شود. این دارو اغلب به همراه شیمی درمانی تجویز می شود.
آنتی بادی، پروتئین خالص شده ای ست که روی سلول های خاصی اثر می گذارد. مزیت آن نسبت به درمان های دیگر مثل شیمی درمانی این است که تمامی سلول ها را تحت تاثیر قرار نمی دهد. بنابراین عوارض جانبی و خطرات طولانی مدت آن در مقایسه با شیمی درمانی کمتر می باشد.
شیمی درمانی: شیمی درمانی به استفاده از داروهایی جهت توقف یا کاهش رشد سلول های سرطانی اطلاق می شود. شمیمی درمانی روی سلول هایی که رشد سریعی دارند (مانند سلول های سرطانی) اثر گذاشته و از تقسیم یا تکثیر آنها جلوگیری می کند. از آنجایی که اکثر سلول های فرد بالغ رشد یا تکثیر زیادی ندارند کمتر تحت تاثیر داروهای شیمی درمانی قرار می گیرند به جر سلول های مغز استخوان، فولیکول های مو و مخاط مجاری گوارشی. عوارض جانبی شیمی درمانی به دلیل تاثیر این داروها بر روی ارگان های سالم بدن می باشد.
ترکیب داروهای شیمی درمانی رژیم شیمی درمانی نامیده می شود. رژیم های مورد استفاده برای درمان لنفوم فولیکولار می تواند شامل داروهای خوراکی باشد که طی یک روز مصرف می شود و یا به صورت دوره ای از طریق ورید به بیمار تزریق شود. یک دوره ی شیمی درمانی شامل زمان های تزریق دارو و فواصل استراحت بین آنها برای بهبودی بدن از عوارض جانبی ناشی از آن می باشد. به عنوان مثال یکی از رژیم های شیمی درمانی مرسوم شامل تزریق وریدی دو یا چند داروی مختلف به مدت یک ساعت می باشد که هر ۳ تا ۴ هفته انجام می شود. این دوره ی چند هفته ای یک دوره ی درمان محسوب می شود. اگر این رژیم ها ۳ یا ۴ دوره تکرار شوند درمان کامل حدود ۴ ماه به طول می انجامند.
رادیوایمونوتراپی:
رادیوایمونوتراپی (RIT) استفاده از ایزوتوپ های رادیواکتیو ذرات آلفا متصل شده به آنتی بادی می باشد در نتیجه پرتو می تواند به طور مستقیم به سمت سلول های سرطانی هدایت شود و دوز کمتری به ارگان های سالم برسد. در لنفوم فولیکولار برای انجام این درمان از Zevalin یا Bexxar استفاده می شود که به صورت وریدی تزریق می گردد. این درمان در بخش های پزشکی هسته ای بیمارستانها انجام می گیرد و پس از درمان فرد می تواند به منزل خود برگردد. تجویز رادیوایمونوتراپی احتیاج به تجهیزات ویژه و پرسنل آموزش دیده دارد.
پیوند مغز استخوان:
این درمان معمولا برای افرادی تجویز می شود که بیماری لنفوم آنها پس از درمان عود کرده باشد.
پیش آگهی لنفوم فولیکولار:
برای بیماران مبتلا به مرحله ی پیشرفته ی لنفوم فولیکولار میانگین بقای بیشتر از ۱۰ سال تخمین زده شده است. علایرغم رشد آهسته ی این بیماری اکثر افراد مبتلا به آن با درمان های موجود قابل معالجه نیستند.
محققان روشی را پیدا کرده اند که از تریق آن می توان طول عمر افراد مبتلا به لنفوم فولیکولار را تخمین زد. این روش همچنین در تعیین اثرگذاری شیمی درمانی برای این بیمارن مفید می باشد. برای این کار از ۵ فاکتور زیر استفاده می شود:
– سن بالای ۶۰ سال
– مرحله ی ۳ یا ۴ بیماری
– کاهش شمار سلول های قرمز خون
– درگیری بیش از ۵ ناحیه ی لنفاوی
– افزایش بیش از حد طیبعی سطح لاکتات دهیدروژناز خون